Analiza łańcucha dostaw surowców
W ostatnich latach łańcuch dostaw stał się bardziej złożony. W wyniku tego wzrasta prawdopodobieństwo wystąpienia niekorzystnych czynników wpływających na jakość danego surowca podczas jego transportu. Dlatego właśnie tak ważne jest dziś poprawne zaplanowanie i wykonanie oceny łańcucha dostaw.

.jpg) |
| Zminimalizowanie ryzyka odchyleń w łańcuchu dostaw może nastąpić poprzez m.in. potwierdzenie warunków przechowywania surowca w trakcie łańcucha dostaw. Niedopuszczalne jest magazynowanie produktu niezgodne z wymaganiami GMP. |
Wymagania co do oceny łańcucha dostaw w Unii Europejskiej (UE) rosną. 8 czerwca 2011 r. w Strasburgu została podpisana Dyrektywa 2011/62/UE dotycząca sfałszowanych produktów leczniczych zmieniająca Dyrektywę 2001/83/ WE, która brzmi następująco: „Liczba wykrywanych w Unii produktów leczniczych sfałszowanych pod względem tożsamości, historii lub źródła pochodzenia wzrasta w alarmującym tempie. Produkty te zwykle zawierają składniki gorszej jakości lub sfałszowane, nie zawierają żadnych składników lub zawierają składniki, w tym substancje czynne, w nieodpowiednich dawkach, co stanowi poważne zagrożenie dla zdrowia publicznego”.
Dyrektywa 2011/62/UE wspomina nie tylko o obowiązkach wytwórców, dystrybutorów i importerów API, ale również substancji pomocniczych. Nie jest to zaskoczeniem, ponieważ ryzyko sfałszowania substancji pomocniczych jest na takim samym poziomie, jak każdego innego składnika produktu leczniczego.
Zagrożenie wynikające z udziału w łańcuchu dostaw sfałszowanych substancji jest duże. Dlatego też poprawnie zaplanowana i przeprowadzona ocena łańcucha dostaw zapewni przede wszystkim odpowiednią jakość produktu leczniczego, jak również ochronę przed wprowadzaniem do łańcucha dystrybucji sfałszowanych produktów leczniczych. To z kolei umożliwia ochronę pacjentów, jak również interesów posiadaczy pozwolenia na dopuszczenie do obrotu oraz wytwórców.
Minimalizacja ryzyka
W łańcuchu dostaw danego surowca mogą zajść odchylenia dotyczące m.in.:
• temperatury,
• wilgotności,
• nadmiernej ekspozycji na światło,
• zanieczyszczenia,
• dodatkowych, niezaplanowanych przeładunków,
• nieplanowanych przepakowań, co w przypadku substancji czynnej (Active Pharmaceuticals Ingredient – API) jest już jednym z etapów wytwarzania.
Zminimalizowanie ryzyka tego typu odchyleń w łańcuchu dostaw może nastąpić poprzez:
• inspekcje/audyty GMP/GDP (Good Manufacturing/ Distribution Practice) wytwórców, importerów, dystrybutorów,
• wykorzystanie analizy ryzyka do oceny wytwórcy, importera oraz dostawcy surowca pod kątem spełniania wymagań GMP oraz dobrych praktyk dystrybucji,
• zapewnienie i potwierdzenie, że dany surowiec był dostarczony z wykorzystaniem zatwierdzonego łańcucha dostaw,
• zapewnienie i potwierdzenie, że dany surowiec był dostarczony przez zatwierdzonego dostawcę, z którym jest podpisana umowa GMP,
• poznanie i kontrolę łańcucha dostaw i tam, gdzie to możliwe, jego skrócenie do minimum,
• opis oraz ocenę w odpowiedni sposób, zgodny z wymaganiami GMP i GDP, udokumentowany,
• potwierdzenie warunków transportu i przechowywania surowca w trakcie łańcucha dostaw,
• sprawdzenie stanu dostawy podczas przyjęcia na magazyn wytwórcy produktu leczniczego (zamknięcia
– czy są oryginalne, nienaruszone opakowania itp.).
.jpg) |
Ocena łańcucha dostaw surowców w systemie zarządzania jakością wytwórcy produktu leczniczego powinna być jednym z elementów analizy ryzyka jakości. Dla łańcucha dostaw powinna ona objąć:
• ocenę wytwórców i dostawców,
• prekwalifikację nowych wytwórców/dostawców,
• regularne audyty/oceny,
• warunki przechowywania/magazynowania i dystrybucji/ transportu,
• komunikację z wytwórcą i dostawcą – szczególnie w momencie reklamacji jakościowych oraz wstrzymań/ wycofań produktów leczniczych z obrotu.
Odpowiednie zabezpieczenia
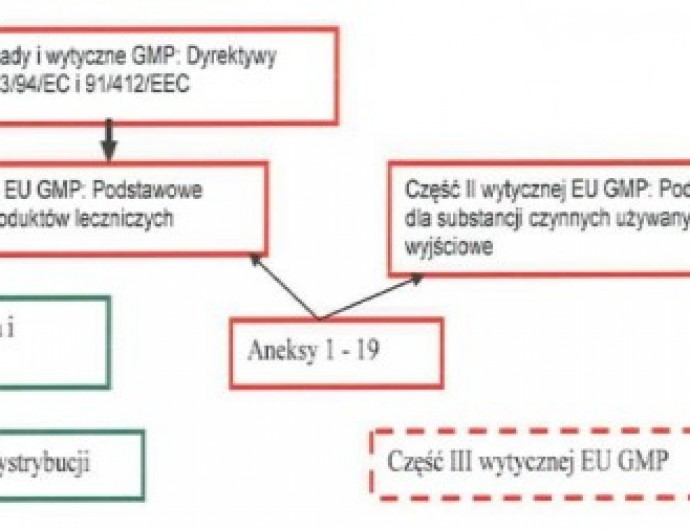
Zabezpieczenia przed zamianą surowców można dokonać na kilka sposobów. Pierwszym z nich jest transport surowców przeprowadzony według zatwierdzonych procedur. Poza tym transport ten powinien być wykonywany przez firmy, z którymi podpisane są umowy zawierające również kwestie związane z GMP i GDP. Ważne jest również, aby w trakcie dystrybucji od wytwórcy do odbiorcy końcowego, którym jest producent leku, nie wystąpiły niezaplanowane przestanki czy przepakowania. GMP w Unii Europejskiej (UE) dotyczące łańcucha dostaw przedstawia rysunek nr 1.
.jpg) |
Po zaimplementowaniu Dyrektywy 2011/62/UE, GMP w UE ulegnie zmianie. Będzie wtedy wyglądało jak na rysunku nr 2.
Wymagania co do oceny łańcucha dostaw stają się coraz bardziej restrykcyjne:
• Dyrektywa 2011/62/UE wyraźnie wskazuje, że: - posiadacz pozwolenia na wytwarzanie sprawdza, czy producent i dystrybutorzy substancji czynnych przestrzegają dobrej praktyki wytwarzania i dobrych praktyk dystrybucji poprzez przeprowadzenie audytów w wytwórniach i miejscach dystrybucji producenta i dystrybutorów substancji czynnych,
- sprawdzenia, że producenci, importerzy lub dystrybutorzy, od których uzyskał substancje czynne, są zarejestrowani przez właściwy organ państwa członkowskiego, w którym mają swoją siedzibę
• nowy proponowany przez EMA (European Medicines Agency – z ang. Europejska Agencja Leków) wzór deklaracji QP – Qualified Person’s Declaration Concerning GMP Compliance of the Active Substance Used as Starting Material and Verification of its Supply Chain, również skłania właściciela zezwolenia na wytwarzanie do weryfikacji łańcucha dostaw API i wskazuje na zwiększone zainteresowanie oraz wymagania władz kompetentnych odnośnie łańcucha dostaw – deklaracja potwierdza status GMP wytwórcy danej API oraz wiedzę wytwórcy produktu leczniczego na temat łańcucha jej dostaw:
- śledzenie historii lub łańcucha dostaw od zakupów krytycznych materiałów wyjściowych wykorzystywanych do wytworzenia API po wytworzeniu produktu leczniczego – pojawia się wymaganie podawania miejsc wytwarzania krytycznych materiałów wyjściowych, API, brokerów, dystrybutorów, miejsca przepakowania, przeetykietowania, miejsca mikronizacji oraz importerów – dane te muszą być ustalone, zatwierdzone i udokumentowane,
- historia łańcucha dostaw musi być dostępna podczas inspekcji oraz na żądanie władz kompetentnych.
* * *
Kluczowymi aspektami oceny łańcucha dostaw są pochodzenie danego surowca (wytwórca), uczestnicy łańcucha dostaw oraz warunki transportu i przechowywania/ magazynowania podczas całego łańcucha dostaw. Poprawnie przeprowadzona ocena łańcucha dostaw pozwoli wytwórcy produktu leczniczego na zminimalizowanie ryzyka zaangażowania surowców nieodpowiednich/sfałszowanych, zminimalizowanie ryzyka wystąpienia niekorzystnych czynników podczas transportu surowców, czyli na obniżenie prawdopodobieństwa narażenia pacjentów na ryzyko związane z niedostatecznym bezpieczeństwem stosowania, nieodpowiednią jakością lub zbyt niską skutecznością wytworzonego produktu leczniczego.
Literatura:
1. Dyrektywa 2004/27/WE Parlamentu Europejskiego i Rady z dnia 31 marca 2004 r. w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi zmieniająca Dyrektywę 2001/83/WE.
2. Dyrektywa Parlamentu Europejskiego i Rady 2011/62/UE z dnia 8 czerwca 2011 r. zmieniająca Dyrektywę 2001/83/WE w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi – w zakresie zapobiegania wprowadzaniu sfałszowanych produktów leczniczych do legalnego łańcucha dystrybucji.
3. Rozporządzenie Ministra Zdrowia z dnia 1 października 2008 roku w sprawie wymagań Dobrej Praktyki Wytwarzania wraz z Załącznikiem do Rozporządzenia.
Autor: Agnieszka Obszańska-Szubart, ICN Polfa Rzeszów S.A.
Artykuł został opublikowany w magazynie "Przemysł Farmaceutyczny" nr 6/2011
Źródło fot.: Agnieszka Obszańska-Szubar; www.sxc.hu